26 - Nouvelle- Calédonie, le Greslania de la Côte Oubliée.

Du Greslania multiflora au Greslania circinata
Robert Kernin, le 08 avril 2015
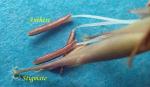
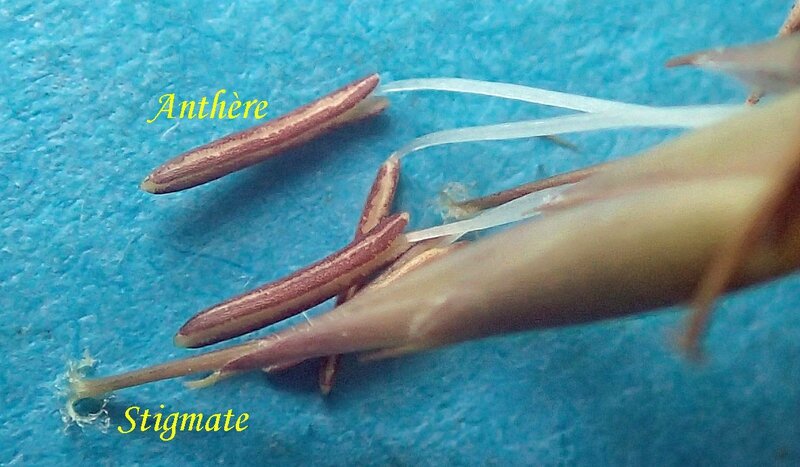
Clé d’identification des espèces du genre Greslania Balansa, en l’absence d’inflorescence
1- Présence d’une branche par nœud à partir de la moitié ou du dernier tiers du chaume
....................................................................................................G.rivularis
1- Absence de branches
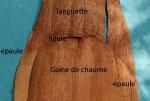
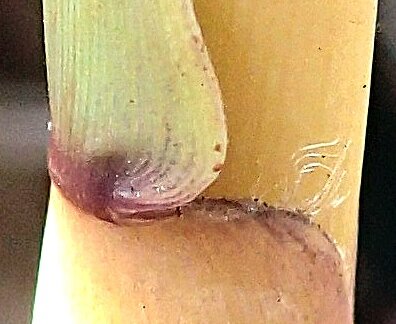
2 – Face dorsale des gaines foliaires glabre
La base des feuilles n’embrasse pas le chaume……………………………..G.circinata
2 – Présence de poils blancs sur la face dorsale des gaines foliaires
La base des feuilles, particulièrement dans le haut du chaume, embrasse ce dernier
………………………………………………………………...................................................G.montana
Le 10 décembre 2014, je me retrouvai sur la côte Est au sud de la Nouvelle-Calédonie, après 4h00 de route et de chemin de terre, dans des paysages qui vous laissent scotchés la bouche ouverte sans respirer et les yeux pas assez grands pour y faire entrer toute leur beauté grandiose. En pleine descente j’ai freiné et ai arrêté en plein milieu de la route, encore existante, mon vaillant petit 4/4. Devant moi se découvrait le début de la Côte Oubliée (photo2),

une grande partie des côtes de la Nouvelle-Calédonie où les routes s’arrêtent, puis les chemins de terre, puis les sentiers. Pour continuer ? Longer la mer à pied, sur 60 km, en direction du sud .
Mais mon but était plus modeste. Il avait pour nom le Pic Nejiri (photo 3, ou l’on peut voir également le début de l’ancien chemin miniers sur les flancs des collines),

d’une hauteur de 1089m, au tout début de la Côte Oubliée. Il y avait là un petit mystère à éclaircir, à propos d’un Greslania, qui avait porté le nom de G.multiflora, et s’était avéré être un synonyme de G.circinata.
Quelque temps auparavant, désirant en connaître un maximum sur ces petits bambous, endémiques de la Nouvelle-Calédonie, j’avais épluché ma bibliographie, puis recherché partout le moindre renseignement.
Il y avait en tout 3 espèces de Greslania, mais durant des décennies il y avait eu une 4e espèce nommée G.multiflora.
Le bulletin ‘Bambou’ n°36 d’avril 2001, avec un article signé Jean-Pierre Demoly, m’a particulièrement intéressé, la preuve était donnée que G.circinata et G.multiflora étaient une seule et même espèce.
Là où tout s’est compliqué, c’est quand je suis tombé sur la planche de dessin n°82 dans le ‘’Camus’’ : j’avais devant moi deux dessins de feuilles, dont les bases étaient carrément différentes ! (photo n°4)

L’une était référencée comme étant une feuille de G.circinata, l’autre une feuille de G.multiflora. Ayant une grande confiance dans les dessins botaniques, il y avait trois possibilités concernant cette feuille de G.multiflora :
- soit on avait donné au dessinateur une mauvaise feuille (erreur peu probable).
- soit il y avait les deux formes de feuilles chez G.circinata, l’une à la base presqu’horizontale et l’autre aux bords de la base remontant à 45°.
- Soit il y avait vraiment un Greslania différent.
Je résolus de résoudre ce dilemme en me rendant sur le terrain, celui d’origine, le lieu même de la collecte originelleJ.
Après quelques recherches sur internet, je trouvai dans l’herbier du Royal Botanic Garden d’Edinburgh la collecte de G.multiflora qui représentait le type, numéroté 15177, collecte qui avait été faite à 1000m d’altitude, sur une crête dominant la rivière Ngoye, en 1902, par F.R.R.Schlechter et décrit en 1906 par le botaniste allemand R K Pilger..
Un contact en Nouvelle-Calédonie, Jean-Pierre Legros, randonneur confirmé connaissant bien la région de la Ngoye sur la côte Est, me détermina la crête en question, et de plus me donna un itinéraire déterminé par satellite (photo 5).

A noter que le nom ‘Ngoye’ est indiqué de nos jours sur les cartes par une orthographe un peu différente : ‘Ngoï’.
Grâce aux indications de Jean-Pierre Legros, à internet et aux fonctions satellites j’affinai le plus précisément possible mon trajet, autant en photos de cotes de relief qu’en coordonnées latitude / longitude. Facilités incroyables de notre époque. Jean-Pierre m’avait prévenu de difficultés possibles en atteignant une altitude vers les 800m, devant passer dans une végétation courte me faisant perdre de vue tout repère visuel.
Je fis une première reconnaissance, qui me conduisit au maximum où je pouvais aller en voiture. 4h00 à 4h30 de trajet (j’habite à 25km au sud de Nouméa), dont la moitié en route ‘normale’, ensuite petite route, puis chemin de terre bordant la mer sur de nombreux kilomètres, passage à vitesse ultra réduite dans les tribus côtières. Je repérai la Ngoi, la rivière que j’aurai à traverser au départ, et l’endroit où je la traverserai. Au long de ce chemin j’ai repéré un pied de Greslania rivularis, côté rivière, et j’en profite pour faire quelques photos.
Ensuite il y aurait une dizaine d’heure de marche aller/retour pour un bon marcheur. M’estimant un marcheur moyen, je rajoutai 2h00. Cela était limite pour une journée de randonnée, d’autant plus qu’une fois trouvé le bambou cela voulait dire 2 à 3h de notes, observations et photos.
Je devais donc prévoir une randonnée sur 2 jours, avec ce que cela impliquait, du matériel supplémentaire et un sac à dos lourd.
Prendre mon temps lors d’une randonnée me convenait très bien, regarder la nature exige du temps, ne pas être tenu par un horaire trop serré est la clé d’une randonnée ‘observation nature’.
Cette partie de la côte Est a donc pour nom ‘’La côte oubliée’’, ce qui lui convient parfaitement, bien que j’ai envie de rajouter ‘et préservée’. Plusieurs tribus occupent les bords de mer (Grand Borendy, Petit Borendy,Port Bouquet,St Jean-Baptiste et St Joseph). Celle du Petit Borendy est la plus proche de mon point de départ. Effectuer le geste de la Coutume lorsque je reviendrai pour ma randonnée me sembla indispensable, c'est-à-dire, par respect pour la population habitant cet endroit, expliquer le pourquoi de ma venue, et offrir une étoffe (manu ou sorte de paréo) accompagné d’un modeste billet, ceci devant être effectué devant le chef de la tribu, en lui demandant son accord pour parcourir la région.
Le 10 décembre, ce dernier, Philippe Nekare, résidant au Grand Borendy mais étant le chef de la tribu du Petit Borendy, étant absent lors de mon passage, c’est donc à son frère que j’eu affaire, et après un discours dans sa langue, ce dernier me parla en Français en me souhaitant la bienvenue et en m’autorisant à faire mes recherches dans la région.
Je poursuivis donc ma route, qui s élevait dans les montagnes sur pas mal de kilomètres, et voilà comment, en ce 10 décembre, je contemplais, à une belle altitude, ce paysage époustouflant. Pas une maison, personne, pas de voiture depuis un bon moment…un mouvement dans mon rétroviseur me surprend… une voiture ! Je m’écarte et un pick-up s’arrête à ma hauteur. C’est là que je fis la connaissance de Radji Kainda, Président du Comité de Gestion de l’Environnement pour la région du Grand Borendy, qui me proposa de venir à une réunion qu’il avait avec la tribu du Petit Borendy, afin d’expliquer le pourquoi de ma présence. Ce que je fis. L’accueil fut d’une gentillesse remarquable, ou l’on m’offrit le café et des litchees pour mon ‘’voyage’’. Il fut établi aussi que si je ne reparaissais pas pour le lendemain soir, l’alerte serait donnée. Je dois préciser que les téléphones portables ne fonctionnent plus dans cette région, à moins d’avoir une liaison satelliteJ.
J’appris aussi que le chemin que j’allais emprunter était l’ancienne piste minière, et l’endroit de ces mines, en haut de la montagne, portait le nom local de Nekando.
Je quittai la tribu alors que la matinée était déjà bien avancée, pour gagner le point ultime où je laisserai ma voiture, en bout de piste, en léger surplomb de la rivière. (point lat 21°48’64’’Sud et long 166°28’12’’Est) (photo 6- fin de la piste carrossable et vue sur le premier bras de la Ngoï ).

Dans la conversation on me prévient tout de même que quelques jours auparavant, en raison des pluies tombées, la rivière Ngoi était difficilement franchissable, mais qu’aujourd’hui çà devrait être possible. A retenir pour l’avenir, laisser passer quelques jours après une période pluvieuse, le temps que les niveaux redescendent.
A 10h30, je me dirigeai vers le premier bras de rivière à traverser. Mon sac à dos est bien chargé (tente, couchage, polaire, petit réchaud pour le café du soir et du matin, quelques fruits, matériel et appareils photos, et tout le petit matériel pour prendre des notes et mesures, de la loupe au pied à coulisses en passant par le cutter pour découper les gaines de chaume et les voir sous toutes les coutures ! Egalement 2 bouteilles d’eau d’1 litre ½ chacune. Je compte sur les ruisseaux de montagne pour refaire le plein.
Mon GPS est le Tom Tom de mon ancienne voiture, qui ici me sert simplement pour la latitude et la longitude. L’un de mes appareils photos a lui aussi un GPS incorporé. De plus je pars avec une bonne douzaine de relevés du chemin, en coordonnées mais aussi en vues satellite éditées sous forme de croquis et cotes d’altitude du chemin, au format A4, et également 2 vues satellites en image, comme si je me trouvais en haut du Pic Nejiri, me donnant une vision incroyable.
Le premier bras de la rivière, ce jour là, se franchit aisément (photo 7),

souvent par les gros galets qui forment un gué, sans mettre le pied dans l’eau, et parfois de l’eau jusqu’aux genoux maximum, attention tout de même au fond instable. J’arrive ensuite sur une partie du lit à sec, ou il faut sauter de gros galet en gros galet, et me dirige vers mon point présumé de traversée du 2e bras (photos 8- le 2e bras est le principal, le courant y est très fort).

L’endroit me semble peu profond, mais après quelques mètres je constate que le courant est bien plus fort que je m’y attendais (photo 9- Contrairement aux apparences, cet endroit s avère dangereux à traverser, vu la force du courant).

Je me retrouve avec de l’eau jusqu’à mi-cuisse, avec des trous plus profonds entre les rochers, sol instable, et équilibre précaire avec mon sac à dos. J’imagine à ce qui pourrait se passer si je perdais l’équilibre et, n’étant pas encore au milieu de la rivière je fais demi-tour, regagne la rive et remonte le lit de galets à la recherche d’un passage plus praticable.
Un peu plus loin je repère un chemin sur la rive opposée et décide de tenter le coup à cet endroit, et après quelques minutes je me retrouve de l’autre côté (photo 10).

Petite pause après quelques émotions dues au fort courant, pendant laquelle je m’aperçois que mon GPS était resté dans la poche latérale de mon pantalon, à mi-cuisse, et qu’il avait bu la tasse durant la traversée. Il ne s’en est jamais remis ! Celui de mon appareil photo prit la relève.
Je reprends ma marche, parallèlement à la rivière en la descendant. Le sol est glissant, des traces de cerfs y sont visibles, et j’entendrai quelques démarrages dans les fourrés le long de la piste, sans jamais voir la bête. Au bout de 10 mn, je glisse et tombe sur mon coude gauche. Les conséquences seront quelques écorchures et la formation d’un bel œuf, je m’en tire bien car la réception de la chute avait été rude et douloureuse.
Après 45 mn de marche je trouve le départ de l’ancienne piste des mines et commence à grimper, le chemin est bordé sur la gauche par une vallée où coule une petite rivière (photo 11).

De nombreux arbustes de grevillea exul (photo 12)

ponctuent la nature de leurs fleurs blanches, et plus rarement grevillea gillivrayi qui me semble être la forme angustifolia (photos 13 et 14)


rajoute sa couleur rouge..
Vers les 300m d’altitude, je subis les inoffensives attaques d’une bande d’hirondelles, peu habituées à voir ici ce genre d’animal qu’est l’humain s’aventurer sur leur fief. C’est sur que là elles sont tranquilles du moins vis-à-vis de nous, elles nichent dans des parois à pic inaccessibles. Des éboulis coupent la piste à plusieurs reprises, mais leur franchissement est facile (photo 15).

De nombreuses mini cascades bordent le chemin.
Au sol, ou formant des lianes dans les arbustes, je vois de nombreuses plantes carnivores (Nepenthes vieillardii photos 16 et 17),


avec des urnes vertes, rouges ou orange. Leurs hampes florales (photos 18 et 19)

de couleur rouge lie de vin sont de toute beauté.

Je croise quelques pieds de Greslania rivularis, et en aperçois plusieurs sur une pente en contrebas, puis plus haut j’arrive à un endroit un peu magique. Un bruit d’eau dans un virage, un ruisseau tombe et a fait son lit, bordé de quelques plants de G.rivularis d’une belle taille, dont un portant des chaumes qui retombent vers le lit du ruisseau (photo 20).

Certains des chaumes sont restés verticaux, on peut voir sur la photo suivante des feuilles qui émergent de la végétation (photo 21).

Je les mesurerai lors de mon retour, 4.10m pour 15.8mm de diamètre. Une partie de ses entrenœuds, surtout vers la base, est recouverte comme d’une peau grise avec des points protubérants, çà me rappelle un genre de cuir. A proximité, un autre pied présente au moins deux chaumes rayés de brun et de vert (photo 22).

Parmi la végétation luxuriante entourant ce point d’eau, un petit palmier endémique a fait sa place (photo 23).

L’endroit est idéal pour une pose de quelques minutes, et refaire le plein des bouteilles.
Plus haut sur la piste, je tombe sur un pied de Greslania circinata en fleurs (photo 24).

Pour l’instant je ne regarde pas spécialement la forme de la base des feuilles, je veux me réserver le plaisir de la découverte sur les plants que je trouverai vers les 1000m. Certains chaumes de ce pied sont morts, d’autres biens vivants présentent des hampes florales bien garnies d’épis (photos 25,

26, 27 et 28).



Je constate que des nouvelles pousses (et non des plantules comme j’en rencontrerai plus haut) continuent d’émerger (photo 29),

ce qui signifie que sur ce même plant certains chaumes sont déjà morts, d’autres adultes bien vivants, et d’autres, que l’on pourrait qualifier de turions ‘avancés’, continuent de pousser.
Après 6h30 de marche, je décide de monter ma tente à 17h00 à 680m d’altitude, dans un endroit avec une superbe vue, et, ne recherchant pas les ennuis, sans trop de blocs rocheux en équilibre au dessus de moi J. Latitude 21°51’10’’ Sud et Longitude 166°29’49’’Est. (photo 30 et 31).


J’envisage de laisser le plus gros de mon matériel à cet endroit demain matin, afin de poursuivre plus léger, ce sera mon camp de base en quelque sorte. J’aperçois au loin la rivière Ngoï, et en la suivant du regard, tout à gauche, l’endroit ou j’ai laissé ma voiture (photo 32).

Je vois également la ligne de crêtes par laquelle je suis monté.
Une fois mon camp installé, j’explore un peu autour, marchant un peu sur l’ancien chemin des mines qui contourne la montagne, et tombe sur une population de G.circinata aux chaumes morts et couchés (photo 33).

Toute cette population longeant une partie du chemin semble morte, mais tout autour des chaumes couchés des centaines de plantules repartent (photos 34 et 35).


Je mesure un chaume mort : 2.90m pour 9mm de diamètre. La hampe florale est comprise dans la hauteur, mais comme elle pousse dans le prolongement du chaume je ne peux diviser ces deux éléments, aucun repère ne semblant indiquer où cette hampe commence.
La soirée m’offre un spectacle grandiose, l’ambiance est spéciale, sentiment d’isolement mais où celui d’être en plénitude avec la nature prend le dessus. Sous mes yeux les montagnes successives se découpent, leur pied baignant dans la mer immense. Je vois, très loin, sur ma gauche, le bras de la rivière où j’ai laissé ma voiture, son lit très large que j’ai suivi avant de commencer à monter, le chemin de l’autre côté se dirigeant vers le petit Burundi, tandis que devant moi le lagon et la mer prennent leurs couleurs argentés de nuit. Sur ma droite les montagnes s’assombrissent et se découpent en ombres chinoises entre la mer et le ciel…
La nuit est fraîche, l’humidité gagne, je me lève pour mieux fermer ma tente, la toile de celle-ci, non doublée, est trempée mais l’eau glisse vers les bords. Tremblant sous le froid je me glisse dans le couchage, le polaire n’est pas de trop Mes vêtements baignés de sueur ne sècheront pas…heureusement il ne pleut pas !
Après un sommeil entrecoupé mais tout de même reposant, le cri d’un oiseau annonce le lever imminent du jour dés 4h du matin. Durant 1h, sans se lasser, il envoie son cri auquel d’autres répondent dans les montagnes, le même cri en trois notes, portant loin, çà résonne. Je ne verrai pas l’oiseau, chants marquant leur territoire ? Appels vers une compagne éventuelle ?
Debout à 5h00, j’enfile mes vêtements humides au petit matin, un café chaud me redonne un tonus d’enfer, je prends en photo notre cher soleil qui se lève (photo 36),

et à 5h45 après avoir enfilé un poncho léger, bien étanche, coupant le froid et dans lequel je suis comme dans une étuve, je pars à la recherche d’un endroit où attaquer la pente, laissant mon camp de base en l’état, et de ce fait mon sac est un peu moins lourd. Au cours de la matinée la température montera doucement, moins élevée qu’en bas, agréable pour la marche.
Je croise un trou très large, situé en plein milieu du chemin minier, impressionnant. Je ne peux apercevoir le fond, et tient une distance de sécurité prudente car les bords me semblent friables. Comment s’est-il formé ? Est-ce une ancienne entrée de puits minier ?
L’ancien chemin des mines ne continue pas vers le sommet, mais part dans une autre direction, contournant la montagne. Par contre je dois pouvoir rejoindre, plus haut, un ancien chemin piétonnier, rejoignant le sommet du Pic Nejiri, et même se poursuivant sur différentes crêtes pour rejoindre le Mont Humboldt (le 2e sommet plus haut de Nouvelle-Calédonie). Je dois donc trouver une pente accessible, et après quelques gros blocs rocheux franchis je me retrouve sur une crête dont la pente est praticable. Cà grimpe bien cette fois, je passe à côté de sortes de puits, de forme parfois carrée, comblés par les ruissellements d’eau et de terre, dans lesquels toutes sortes de plantes ont pris racine, dont des Greslania circinata. Je pense que c’est là d’anciennes entrées de mines (photo 37 et 38).


De grosses pierres, semblant avoir été taillées, sont parfois à proximité, ainsi que des murets formés de pierres volcaniques noires, cela me fait penser à des tombes mais çà pourrait être plus simplement des plates-formes entourant l’entrée des puits.
Autour de moi des dizaines de Greslania circinata sont visibles, disséminés dans une végétation très variée. Certaines touffes n’ont pas fleuries dans certains secteurs, alors que dans d’autres secteurs elles sont décimées, mais dans ce cas des centaines de plantules repartent déjà. Une sorte d’ancien sentier, pas très clairement marqué, facilite mon avancée, d’autant plus que la végétation est courte et clairsemée. Je vois ce qui me semble être des Araucaria de petite taille (photo 39 et 40) sans en être certain.


Vers les 830m, avec toujours G.circinata occupant la zone, et après un passage en pente sur un affleurement de roche rouge friable, une sorte de sentier s’engouffre sous une végétation luxuriante, relativement courte mais dense, avec la présence, entre autres, de nombreux palmiers de taille réduite (photo 41),

Il faut plonger sous le couvert dans un creux, puis remonter pour retrouver la crête avec une visibilité. Mais au bout de quelques mètres, impossible de passer, il me faudrait une machette. J’essaie de trouver un autre passage en contournant un sommet, Je me faufile à travers de nombreux troncs d’arbres morts, encore debout ou gisant au sol (photo 42),

gris et secs, avec des branches aux formes tourmentées, posés sur des tapis de lichen blanc (photos 43 et 44).


Je me heurte à une végétation d’une autre nature, des petits troncs d’arbustes de végétation plus sèche, formant une barrière dense plus haute que moi. Je dois m’arrêter là, n’étant pas équipé pour me frayer un chemin. Je me rappelle les recommandations de Jean-Pierre Legros, rencontre d’un couvert végétal…
Petite inquiétude d’un moment, je m’aperçois que ma montre n’est plus à mon poignet, sans doute arrachée dans mes tentatives de passage. Cependant de longues minutes plus tard je la retrouve, bien à sa place, elle avait simplement tournée autour, et était remontée sur mon bras, cachée par les manches du poncho ! ouf ! mais la fatigue doit y être pour quelque chose J
830m d’altitude, Latitude 21°51’19’’Sud et Longitude 166°29’34’’Est, tel sera mon point ultime pour cette première expédition vers le Pic Nejiri. Il est seulement 7h10 du matin, 1h25 m’ont suffit depuis mon camp de base pour atteindre ce point situé à 150m au dessus, rechercher un passage et devoir renoncer.
Je redescends sur quelques dizaines de mètres pour retrouver une sorte de plateau ou j’ai croisé beaucoup de bambous (photo 45).

Ne pouvant atteindre les 1000m, le moment est venu d’observer de plus près les feuilles de G.circinata et je trouverai sur le même plant les deux sortes de feuilles, l’une à la base presque à l’horizontale, et l’autre à la base formant des angles même au-delà des 45° comme vu sur le Camus, atteignant les 30 degrés. Le mystère des dessins du Camus est levé, leur légende aurait pu aussi bien être inverséeJ (photo 46).
 .
.
Tout de même, pour le fun, je retenterai bien un jour l’ascension vers le Nejiri, en prévoyant même une journée de plus, et en équipe, le franchissement de ce couvert végétal luxuriant me tente bien, ainsi que de passer un peu de temps à l’observation des plantes qu’il habite.
Après quelques regards sur ce paysage extraordinaire (photo 47),

retour à ma tente, et, après l’avoir manquée et descendu un peu trop bas, je me repérai, retrouvai l’endroit. Une petite pause, préparation du sac à dos, et début de la descente à 9h00.
Je recroise un grand arbre au houppier rouge (photo 48),

puis plus basfais un arrêt prolongé dans le virage du ruisseau et des G.rivularis, pour y prendre photos et notes ainsi que refaire le plein d’eau. Le trajet du retour se fait tranquillement, j’essaie de rester concentré sur chacun de mes pas, la descente est toujours propice aux glissades (photo 49).

Je fais de courtes haltes pour soulager mes épaules et profiter du paysage. Quand j’atteins la plaine alluviale je redouble de prudence, le sol étant parfois glissant. Je retrouve les traces des cerfs, et un galop dans les fourrés, tout proche, me signale leur présence, mais je ne les verrai pas non plus au retour.
Je réfléchis au moyen de passer le bras de rivière d’une manière un peu plus sécurisante qu’à l’aller. Finalement je me taille deux cannes dans des branches ramassées le long du chemin de manière à me faire des points d’appui supplémentaires dans l’eau. Cela fait merveille et la Ngoï se laisse traverser lentement mais beaucoup plus surement. Le deuxième bras franchi je retrouve ma voiture à 13h30. La descente s’est effectuée en bien moins de temps que la montée !
J’ai consommé 5 litres d’eau depuis hier matin, en 27h. J’avais laissé une bouteille de glace dans une glacière dans la voiture, au cas où. La glace a bien sur fondue, mais il me reste cette réserve ainsi qu’un litre d’eau des montagnes pour les 4h de la route du retour. J’ai les épaules en vrac, mon sac à dos était un peu trop lourd et je manquais sans doute de technique pour bien le fixer, comme j’en ai discuté par la suite avec des amis.
Petit arrêt dans la tribu pour signaler que tout s’est bien passé. Firmin m’accueille avec toute sa gentillesse, m’offre le café et un ananas pour la route !
Il savait que j’arrivais chez lui car un oiseau lui signale par son chant tous les évènements inhabituels et les visites. Langage et sagesse de la nature ainsi que des hommes qui savent encore l’écouter.
Remerciements : un grand merci à mon ami Gérald Cauvin, qui, le jour où il m’a offert les 2 volumes du Camus, ne se doutait pas que deux dessins de ces ouvrages, véritables trésors, allaient être à la base d’une superbe aventure à l’autre bout du monde. Merci aussi à Jean-Pierre Legros pour son aide logistique qui a été déterminante dans mon projet (voir carte de la photo n°5), Merci à Radji Kainda pour m’avoir fait rencontrer la tribu du Petit Borindi.
Merci à la tribu du Petit Borindi pour leur accueil convivial et les litchees que j’ai savouré au cours de ma randonnée, et de m’avoir permis de sillonner les montagnes. Un merci particulier à Firmin, pour son humour et sa gentillesse, l’ananas était super bon, j’ai replanté la queue et il donnera d’autres fruits dans 2 ans.
Bibliographie :
- Les Bambusées – E.G.Camus – 1913
- The Bamboos of the World- D.Ohrnberger-1999.
- Notes chorologiques et systématiques sur des taxons du genre Greslania Balansa – Jean-Pierre Demoly – Bull. Bambou n°36 avril 2001.
- Greslania circinata and Greslania rivularis (Poaceae-Bambusoideae) from New Caledonia - S.Dransfield – The herbarium, Royal Botanic Gardens, Kew, Richmond, Surrey – TW9 3AE, UK – The Journal of the American Bamboo Society -16(1):1-8. 2002
- Herbier du Royal Botanic Garden d’Edinburgh – par internet-
Photos : Robert Kernin. exceptées les suivantes:
- La photo n°4 est une copie du livre LES BAMBUSEES de E.G.Camus – 1913.
- La photo n°5 est l’œuvre et le résultat des recherches de Jean-Pierre Legros, et représente la copie du trajet, déterminé par satellite, d’après les renseignements succins que je lui avais fourni.